I modelli cinetici dell'urea nell'Insufficienza Renale Cronica
A cura del Dr. Salvatore Mandolfo
I modelli cinetici trovano fondamento sui principi della conservazione della materia. La loro applicazione consente di descrivere e predire le variazioni di concentrazione di un soluto nel tempo e di interpretarne analiticamente i dati. 1 modelli utilizzati nel paziente uremico, derivano dai principi di farmacocinetica, nei quali l'organismo viene schematizzato in uno o più compartimenti ("pools") comunicanti fra di loro con processi di cinetica di primo ordine.
In accordo a tali modelli, la quantità di un soluto all'interno di un volume di distribuzione diminuisce secondo una curva di tipo esponenziale, esprimibile come:
Q(t)= Q0 exp (-k
* t)ove Q0 è la quantità del soluto al tempo zero, k è il rapporto fra clearance e volume e t rappresenta il tempo.
Tra i soluti utilizzati come "markers" di uremia, l'urea è sicuramente il più utilizzato in quanto è facilmente determinabile nel sangue e nelle urine, ha un volume di distribuzione pari all'acqua corporea, rappresenta il prodotto finale del catabolismo proteico, la sua clearance frazionare normalizzata per il volume di distribuzione (KTIV) si correla con la mortalità e la morbilità, come dimostrato, nel paziente sottoposto a emodialisi.
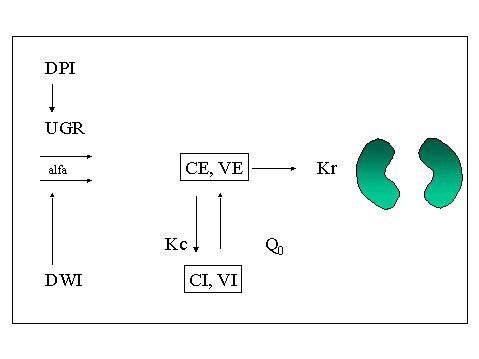
La Figura 1 rappresenta il modello a doppio compartimento a volume variabile utilizzato per descrivere la cinetica dell'urea nell’insufficienza renale cronica in trattamento conservativo.

dove DPI = introduzione di proteine; UGR = urea generata; DWI= introduzione di acqua; alfa = aumento di volume; CI= concentrazione del soluto intracellulare; CE= concentrazione del soluto extracellulare; VI= Volume di distribuzione intracellulare; VE= volume di distribuzione extracellulare; Kr= funzione renale residua; Kc= coefficiente transcellulare per l'urea; Q0=coefficiente transcellulare per l'acqua.
Il bilancio azotato
In condizioni di equilibrio metabolico, esiste una stretta relazione fra proteine introdotte con la dieta, catabolismo proteico e urea generata. Occorre comunque ricordare come l'urea generata dall'organismo deriva non solo dal catabolismo delle proteine, ma anche dall'ammonio riassorbito dall'intestino attraverso il circolo portale. Nel paziente in trattamento conservativo, il termine , urea generata" viene sostituito con urea apparente" (UNA), quest'ultima rappresenta la quantità di azoto ureico urinario (UUN) e non urinario (NUN).
Per stimare il bilancio azotato (Nb), si ricorre alla seguente formula:
Nb (g/N/die) = NI – ((UUN + NUN + APU) + DAzoto
ove NI (g) = introito di azoto, UUN (g) = azoto ureico urinario, NUN (g) = azoto ureico non urinario, APU (g) = azoto proteico urinario, D Azoto (g) = variazioni del pool azotato.
Per il calcolo del DAzoto, occorre fare riferimento alla seguente formula:
deltaAzoto = [(Urea (i) * V) – (Urea (f) * V)]
dove Urea (i) = inizio, Urea (t) = fine studio, V = volume dì distribuzione dell'urea.
Per il calcolo di V è conveniente utilizzare le formule antropometriche proposte da Watson per la stima dell'acqua corporea totale
In pratica è necessario calcolare, per almeno 3 giorni, l'introito proteico dietetico (dividere il valore per 6,25 per ottenere il NU, al primo e all'ultimo giorno dello studio, eseguire dei prelievi per azotemia e pesare il paziente, raccogliere le urine delle 24 ore, determinarne l'azoto ureico (azoturia diviso 2,14), la proteinuria (dividere il valore per 6,25 per ottenere APU), stimare il NUN attraverso il peso corporeo (Kg) del paziente moltiplicato per 0,031.
Esempio pratico:paziente di 60 kg, con una diuresi di 1250 ml/die, una azoturía dí 1500 mgldl, un 'introito proteico di 1,2 glkg, una proteinuria di 3 gldíe, peso e azotemia stabili in corso di studio, avrà un UUN pari a 8,76 (gl7VIdie) e di NUN pari a 1,86 (glNldie), il suo bilancio azotato sarà pari a 0, 42 gINIdie.
Tab 1: Fattori che possono influenzare il bilancio azotato nel paziente uremico:
Antibiotici orali (> bilancio azotato)
Diarrea (> contenuto fecale di Azoto)
Uso di lattulosio (> contenuto fecale di Azoto)
Assunzione
di aminoacidi (sia per os sia e.v.)
L’azotemia rappresenta insieme alla creatininemia, uno dei parametri indispensabili per valutare la funzione renale. In corso di insufficienza renale, i valori di azotemia, a loro volta, sono in relazione all'introduzione di proteine con la dieta.
I modelli cinetici dell'urea trovano applicazione in questo campo in quanto consentono di predire la concentrazione di tale soluto in funzione della quantità di proteine prescritte con la dieta. E’ possibile calcolare tale valore, attraverso la seguente formula:
C
= [ ( ( ( DPI – 0,17 ) * 0,184 ) * V ) Kr ] * 2,14
ove C (mgldl) = concentrazione urea, DPI (gldie) = introito di proteine, V (litri) = volume di distribuzione dell'urea, Kr (ml/min) = clearance residua urea.
Esempio: paziente di 60 Kg, dieta prescritta pari a 60 grammi di proteine, Kr = 7 (ml/min) dovremo attendere un valore di urea pari a 117 mg/dl.
Se il valore di urea sarà maggiore a quello previsto, occorre ipotizzare un introito di proteine con la dieta più elevato, una condizione di ipercatabolismo (vedi Tabella 2), un errore nella stima del volume o infine un errore di valutazione della funzione renale residua, quale ad esempio una raccolta inadeguata e/o un errore di determinazione del laboratorio.
In altri termini, conoscendo il valore della funzione renale residua, è possibile consigliare la quantità di proteine al fine di mantenere valori di azotemia al di sotto di un determinato valore.
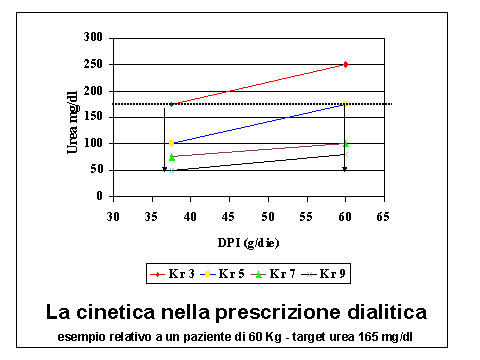
Esempio: per un paziente di 60 kg (vedi Figura 2), se vogliamo mantenere valori di azotemia inferiori a 165 mg/dl. in presenza di Kr pari a 5ml/min, potremo consigliare una dieta di 60 gr. Quando la Kr sara' ridotta a 3 mil/min, sara' necessario prescrivere una dieta di 37 gr.
Tab 2: Condizioni
di ipercatabolismo:
· Inadeguato apporto calorico (< 30 Kcal/Kg peso
corporeo)
· Inadeguato apporto proteico (< 0,75 – 1 g/Kg)
· Stato Febbrile
· Malattie sistemiche
· Acidosi metabolica
· Assunzione di steroidi
Uno
degli aspetti fondamebtali nella gestione ambulatoriale del paziente con
insufficienza renale cronica e’ valutare la compliance terapeutica e dietetica
La
cinetica dell’urea riesce a fornire un supporto valido nel valutare la
compliance relativa all’introito di proteine.
Una
formula molto semplice da utilizzare e’ quella prposta da Maroni e Mitch, ove
l’introito proteico puo’ essere stimato in modo accurato attraverso la
seguente equazione:
DPI
= 6,25 * (UUN + 0,031 * peso corporeo) +PPU
Ove UUN (g) = azoto ureico
urinario, PPU (g) perdita di proteine con le urine
Esempio:
paziente
di 60 Kg, azoturia 1500 mg/dl, diuresi 1250 ml, proteinuria assente, avra’ un
introito proteico stimabile in 66.4 g/die
La
scelta dell’inizio della terapia sostitutiva e’ sempre un momento
particolarmente difficile per il nefrologo in quanto se da una parte un inizio
tardivo espone il paziente a patologie (malnutrizione, neuropatia) che possono
pregiudicarne la qualita’ di vita in dialisi, un inizio precoce sottrae al
paziente un certo periodo di indipendenza dalla dialisi e comporta un inutile
sacrificio di risorse economiche per la societa’
I
modelli di cinetica dell’Urea, pur in assenza di evidenza, possono essere
d’aiuto. In questo caso, come suggerito dalle linee guida americane, si
utilizza l'’ndice wKrT/V, ove w corrisponde ai giorni di una settimana (=7),
Kr e’ la clearance residua dell’Urea (ml/min), T sono i minuti di una
giornata (=1440) e V e’ il volume di distribuzione dell’urea (ml).
Esempio
Paziente
di 70 Kg V stimato in 40600 ml, Kr
= 10 ml/min avra’ un wKrT/V pari a 2.48
In
accordo al modello di Gotch, il trattamento sostitutivo va iniziato quando il
valore di wKrT/V e’ inferiore a 2.0
Esempio
Per pazienti di 60 Kg (V = 34.8 l) e di 80 Kg (V=46), la dialisi andrebbe iniziata rispettivamente per valori di Kr inferiori a 7 ml/min e 9.2 ml/min+
Formula per la stima
del volume di distribuzione dell'Urea (Watson)
![]()
Uomini: 2.447- (0.091 * eta') + (0.107 * altezza) + (0.036 *
peso)
Donne: 2.097+ (0.107 * altezza) + (0.247 * peso)